Diseñar un dispositivo médico puede ser un proceso muy complicado. Los estándares del campo de la medicina que a lo largo de los años se han formado (y que continúan cambiando) pueden ser difíciles de cumplir, incluso con los productos más sencillos.
El principal estándar para equipos eléctricos médicos, IEC 60601-1, garantiza que los productos eléctricos de muchos mercados y países se ajusten a la seguridad y eficacia básicas. El estándar es un conjunto universal de requisitos de seguridad y, aunque la mayoría de los países han adoptado sus propias versiones, tiene en esencia el mismo material principal que cubre diversas áreas de la electrónica y las aplicaciones.
Pero diseñar un dispositivo médico es mucho más que seguir una norma (o estándar) IEC. Este documento analizará la norma IEC 60601, su propósito en el pasado, el presente y el futuro.
Breve descripción del IEC 60601
Las normas IEC existen desde hace más de 80 años, y la primera norma abarcaba el vocabulario electrotécnico (ahora llamado Electropedia). La Comisión Electrotécnica Internacional (IEC: International Electrotechnical Commission) publicó en el año 1977 la norma original IEC 60601, cuando la electrónica empezaba a desempeñar un papel importante en la instrumentación y los tratamientos médicos. En 1988 se publicó una segunda revisión, más centrada en la seguridad del paciente, y no fue hasta la tercera edición, recién publicada en 2005, cuando el equipamiento y la protección de los pacientes se hicieron aún más rigurosos.
Si bien el cumplimiento de estos estándares mediante pruebas y desarrollo puede ayudar a llevar un dispositivo médico al mercado, no lo garantiza. Quizás la etapa más costosa y que requiere más tiempo es obtener la aprobación de la FDA (o su equivalente fuera de los EE. UU.) a través de ensayos clínicos que demuestren la eficacia general del dispositivo.
La mayoría de las empresas que desarrollan y fabrican dispositivos médicos siguen un sistema general de control de diseño como:
- 1. Un caso de negocio y las necesidades de los usuarios que derivan de la investigación de mercado
- 2. Los requisitos de diseño que pretenden responder a las exigencias de los usuarios
- 3. Una verificación del diseño que lo pone a prueba y garantiza que cumple los requisitos del mismo
- 4. Una validación del diseño que lo pone a prueba y garantiza que cumple con las exigencias de los usuarios
- 5. El envío del diseño a fabricación, y luego su lanzamiento
Sin embargo, en el caso de los dispositivos médicos, suele haber elementos especiales que se incorporan a estas etapas, entre ellos:
- • Diseñar componentes electrónicos que se ajusten a los estándares IEC 60601 y, posteriormente, ponerlos a prueba durante la verificación y validación
- • Un proceso de gestión de riesgos que describe los peligros potenciales y cómo se controlan
- • Llevar a cabo un ensayo y registrar suficiente información para crear una investigación y, de esta forma, mostrar a la FDA que su producto es seguro y está listo para su lanzamiento
Mientras el tercer punto se centra más en los ensayos con los pacientes y la documentación, es importante que los diseñadores de productos eléctricos comprendan los dos primeros puntos, ya que son los que, en última instancia, impulsan el proceso de diseño y todos los niveles adicionales de protección. Según la clase de dispositivo, la protección puede ser bastante amplia.
Clases de dispositivos médicos
Existen tres clasificaciones para un dispositivo médico basadas en el riesgo general asociado a su uso. La Clase I es la más baja, mientras que la Clase III es la más alta y requiere una solicitud de aprobación previa a la comercialización (PMA: pre-market approval), antes del lanzamiento. La intensidad del diseño con respecto a la seguridad es máxima para un dispositivo de Clase III y puede constar de varios niveles de redundancia y protección, mientras que la Clase I requiere menos precauciones y gestión de riesgos.
Los dispositivos médicos de Clase I son, por lo general, equipos o accesorios clínicos no invasivos, muchos de los cuales se utilizan normalmente en casa, como las curitas, las mascarillas, los depresores linguales o el termómetro (aunque en función de su precisión y de si es o no electrónico, este dispositivo puede entrar en la Clase II).
La mayoría de los dispositivos médicos de Clase II se utilizan para el diagnóstico o los tratamientos, y tienen un mayor nivel de gestión de riesgos o daños potenciales. Ejemplos de dispositivos médicos de Clase II son: los monitores de glucosa, los brazaletes de presión arterial, las bombas de jeringa o cualquier otro instrumento ligeramente invasivo.
Los dispositivos médicos de Clase III tienen el nivel más alto de gestión de riesgos. Algunos ejemplos son: los implantes, los equipos de soporte vital y los dispositivos electrónicos que monitorean y transmiten información y estados de salud críticos. El cumplimiento de la norma IEC 60601 es necesario para comercializar los dispositivos médicos, pero además de estos estándares, en ocasiones hay que tomar precauciones adicionales (derivadas de la gestión de riesgos o del diseño general para la confiabilidad/seguridad).
Ejemplos de dispositivos médicos Clases II y III
Es muy raro que un dispositivo clínico de Clase I contenga componentes electrónicos, así que pasemos a los ejemplos de Clases II y III. Para nuestro ejemplo de Clase II, veremos el termómetro. Un diagnóstico erróneo de la temperatura puede ser importante, por lo que vamos a revisar algunas de las características comunes de seguridad y confiabilidad en el diseño de uno de estos dispositivos.
Para comenzar, la mayoría de los termómetros son digitales, por lo tanto, tienen una pantalla o display o, al menos, alguna forma de transmitir los datos a distancia. Siendo este el caso, es seguro asumir que hay un microcontrolador incluido en el dispositivo.
La figura 1a muestra el funcionamiento interno de un termómetro típico, con algunas capas de protección añadidas. Para la conversión analógica a digital, se puede utilizar el ADC interno de un microcontrolador (MCU) o un ADC externo. Dado que los ADC externos pueden tener una mayor resolución (y asumiendo que querría al menos una resolución de 16 o 24 bits), y que los ADC internos de la MCU son conocidos por requerir una calibración adicional, hemos incluido un ADC externo con una tensión de referencia limpia y precisa.
Una cosa adicional a tener en cuenta para este ADC es que puede resultar influenciado por la temperatura ambiente, por lo que es mejor aislarlo físicamente en la PCB a través de ranuras (como se muestra en la Figura 1b) para minimizar la variación de la temperatura para las aplicaciones de alta sensibilidad/precisión. Para la parte de detección analógica, el filtrado de paso bajo puede ayudar a suavizar y promediar los datos, mientras que las ferritas en las señales de los termistores pueden ayudar a eliminar el ruido de alta frecuencia y el acoplamiento inductivo cercano. Se pueden utilizar termistores redundantes para los sistemas que requieren una mayor confiabilidad. Se puede añadir una supervisión de reinicio para proporcionar una función de bloqueo por subtensión (o reinicio) que garantice que el microcontrolador (y sus periféricos) solo se utilizan cuando están suficientemente alimentados y estables, lo que protege contra lecturas falsas o inexactas. Por último, la parte de transferencia de calor de un termómetro es fundamental y puede requerir compensaciones y una calibración adicional (después del montaje físico) debido a la pérdida térmica durante la transferencia del calor corporal al termistor.
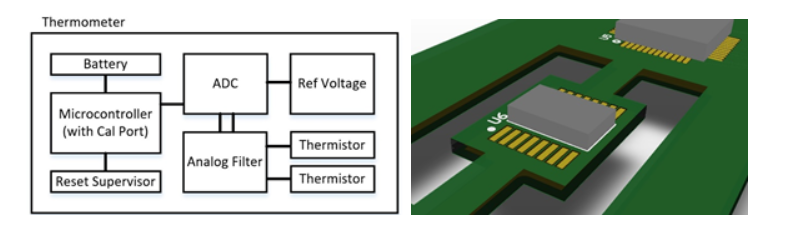
Figura 1a Figura 1b
Figura 1. Ejemplo de a) Diseño de termómetro digital con protección, seguridad y confiabilidad añadidas y b) Estrategia de diseño de PCB para minimizar la variación térmica de un ADC (U6)
Para el ejemplo de Clase III, veremos un marcapasos. Los marcapasos existen desde hace tiempo, 60 años para ser exactos. Lo que entonces comenzó como un diseño sencillo, basado en la tecnología analógica (Figura 2a) ahora se ha transformado en un diseño muy complejo, basado en circuitos digitales, con análisis y generación de señales avanzadas (Figura 2b). Desde la perspectiva de la seguridad y la confiabilidad, los circuitos analógicos generales presentan menos riesgos que los componentes digitales programables, debido a los posibles fallos y a las complejas máquinas de estados. Sin embargo, cabe destacar que los recientes diseños digitales cuentan con componentes integrados con ADC de alta precisión para las mediciones de detección de ECG y DAC para la generación de pulsos. Esto puede proporcionar funciones de creación de ritmos altamente eficaces y ajustables con respuestas de bucle cerrado. Pero, como en la mayoría de las aplicaciones, la mayor parte de la confiabilidad del diseño proviene de la parte analógica, como el filtrado, los preamplificadores bien diseñados, temporizadores y osciladores dedicados, y la incorporación de estrategias de diseño de PCB para minimizar el ruido, el acoplamiento y la variación de temperatura.
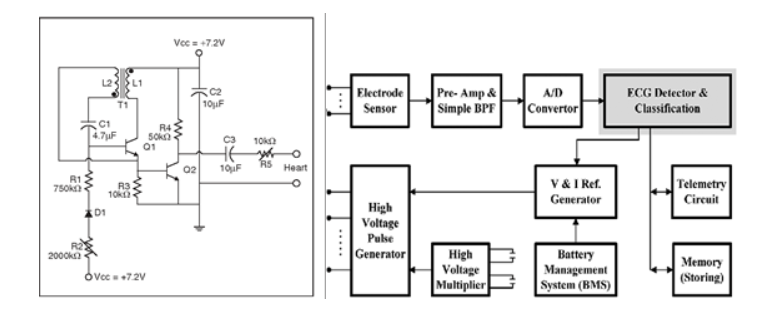
Figura 2a Figura 2b
Figura 2. Ejemplos de a) Diseños de marcapasos analógicos y b) Digitales
Lista de estrategias de diseño para maximizar la seguridad y la confiabilidad
A continuación, se proporciona una lista general de consideraciones de diseños para aumentar la seguridad y la protección de los dispositivos médicos, o de cualquier otro que lo requiera.
- • Seguridad incorporada (hoy en día es habitual en las MCU de gama alta) con autenticación y memoria externa dedicada para datos confidenciales de pacientes y registros
- • Circuitos de supervisión y otros componentes de administración de potencia que contribuyen a la estabilidad de los rieles de tensión y evitan las condiciones de subtensión, sobretensión y sobrecorriente, en especial, en las aplicaciones alimentadas por baterías
- • Incorporación de fusibles reprogramables para ayudar a proteger los circuitos críticos
- • Incorporación de ferritas y supresores ESD en las conexiones externas para ayudar a proteger del ruido de alta frecuencia y de los transitorios parásitos
- • Redundancia en los componentes críticos
- • Estrategias de diseño de PCB que ayudan a minimizar el impacto de las condiciones ambientales o locales, como la temperatura o las posibles interferencias electromagnéticas
- • Filtrado de las conexiones de sensores que se muestrean a altas tasas de transferencia de datos para ayudar a suavizar y promediar la información
- • Rutinas de calibración ocasionales para componentes programables que pueden tener ganancias o compensaciones que cambian con el tiempo
- • Sistemas entrelazados cuando se utilizan componentes potencialmente inseguros, como láseres o motores
Matriz de peligros/riesgos
Una matriz de riesgos (que se muestra en la Figura 3) se puede utilizar para impulsar un diseño sólido y de bajo riesgo y, por lo general, se usa para crear un caso sólido para un producto seguro y confiable durante el lanzamiento. Una matriz de riesgo típica enumera cada peligro razonable y potencial de un sistema, lo califica en términos de impacto/gravedad, probabilidad/ocurrencia y, basándose en esos valores, si ese peligro es aceptable.
Incluso si algunos peligros son aceptables, todavía puede haber interés en controlar el riesgo para mitigar el daño o la ocurrencia, pero el objetivo es delinear cada punto de falla que puede conducir a un daño (al usuario o al sistema) y cómo se controlará o gestionará con un riesgo aceptable. El resultado de estas medidas de control de riesgos suele conducir a tareas de diseño como la protección adicional, la redundancia y la recuperación del sistema. Algunas tareas pueden incluso simplemente preparar el “diseño de acuerdo con el estándar IEC 60601” para abordar el riesgo asociado a él.
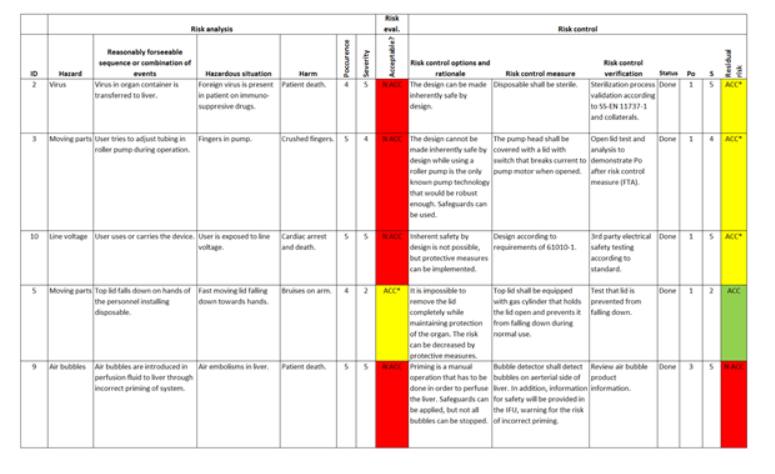
Figura 3. Matriz de trazabilidad de peligros para la gestión de riesgos de un dispositivo médico.
Conclusión
Los dispositivos médicos, sin duda, requieren más rigurosidad en el diseño y la planificación que un producto normal, pero pueden variar bastante en función de la clasificación y la aplicación. Aunque el estándar IEC 60601 es una guía útil, contar con un proceso de gestión de riesgos que permita hacer un seguimiento de los posibles peligros y describir cómo se controlan, puede ser de gran ayuda para justificar un producto aceptable, al tiempo que ayuda a los diseñadores a maximizar la seguridad y la confiabilidad.
Referencias:
Imagen de la Figura 2a: artículo: “La evolución de los marcapasos”, por S. Haddad, R. Houben, W. A. Serdijin
Imagen de la Figura 2b: artículo: “Diseño de un detector de ECG basado en ondas para marcapasos cardíacos implantables”, por Y. Min, H. K. Kim, Yu-Ri Kang, Gil-Su Kim, J. Park, y S. Kim
Imagen de la Figura 3: sitio web - https://medicaldevicehq.com/fmea-vs-iso-14971/


